
粤港澳中枢神经再生研究院李晓江团队新研究成果揭示遗传性帕金森疾病新机制
11月20日,暨南大学粤港澳中枢神经再生研究院李晓江团队在Protein & Cell(IF 14.870)杂志上在线发表了研究长文(Research Article)“PINK1 kinase dysfunction triggers neurodegeneration in the primate brain without impacting mitochondrial homeostasis”(灵长类大脑中PINK1激酶的功能异常可造成神经变性而不影响线粒体稳态)。该项研究利用基因编辑猴模型与死亡人脑组织深入研究帕金森病致病基因PINK1的表达与功能,颠覆了长期以来建立在体外与小动物实验基础上的经典理论,为治疗帕金森疾病提供了新的思路及依据。


(论文截图)
帕金森病 (Parkinson’s Disease, PD) 作为仅次于老年痴呆的第二大神经退行性疾病,在全球65岁以上人群中的发病率高达1-2%。其中PINK1基因突变可因功能缺失而引发遗传性帕金森疾病。长期以来,帕金森疾病被认为与细胞内供应能量的细胞器(线粒体)损伤有关而PINK1作为一种线粒体膜蛋白维护正常线粒体从而保护神经细胞。此经典理论主要是根据体外培养细胞实验中受损的线粒体可招募全长的PINK1蛋白而激活Parkin及泛素酶形成复合物结合受损线粒体,使其能被溶酶体及时清除。
暨南大学粤港澳中枢神经再生研究院李晓江团队曾在2019年报道PINK1基因编辑猴的大脑出现严重的神经细胞变性死亡(Yang et al., Cell Res. 29:334-336, 2019),这与Pink1基因敲除小鼠模型到老年时期仍无明显神经细胞死亡的特征形成了鲜明对比。经过深入研究,李晓江团队发现PINK1蛋白在灵长类大脑中表达丰富,而在小鼠体内难于检测到 (图1)。

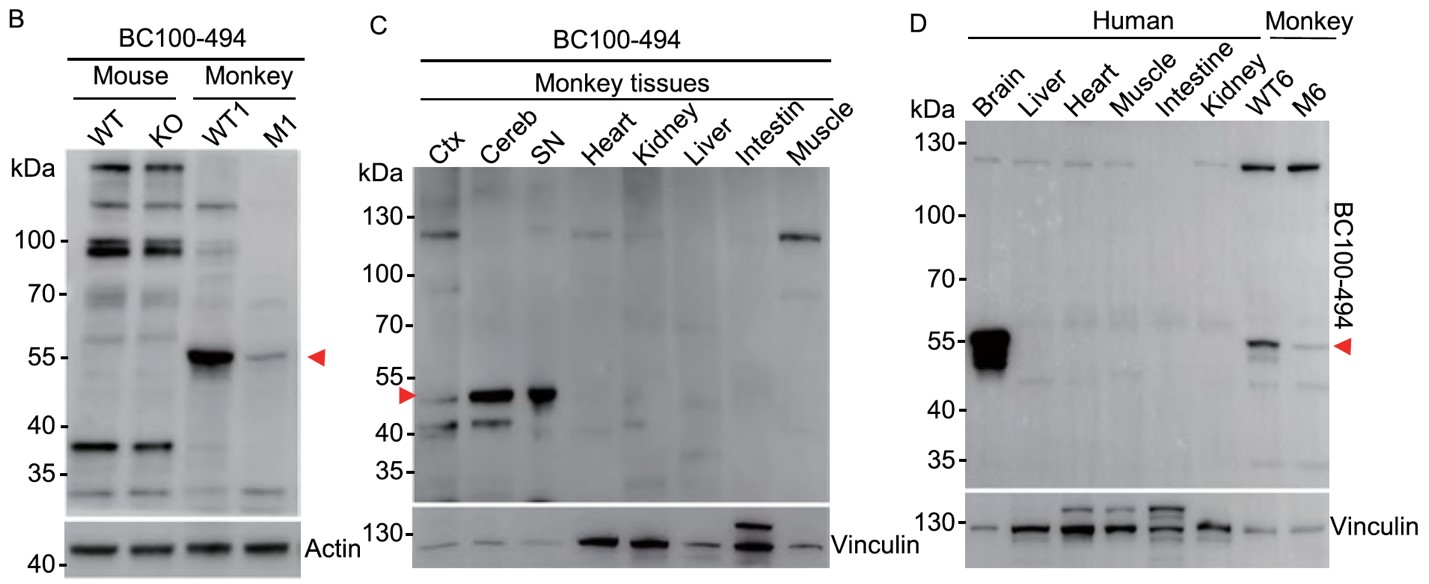
图1. PINK1蛋白在小鼠、猴以及人体内的表达情况
灵长类神经细胞的存活并不依赖于经典学说中所描述的PINK1对线粒体的调控作用,而是PINK1作为激酶通过磷酸化神经细胞功能相关蛋白来维持神经细胞的生存。此主要功能与大量体外培养细胞实验中通过线粒体应激而观察到的PINK1介导的线粒体自噬截然不同 (图2)。
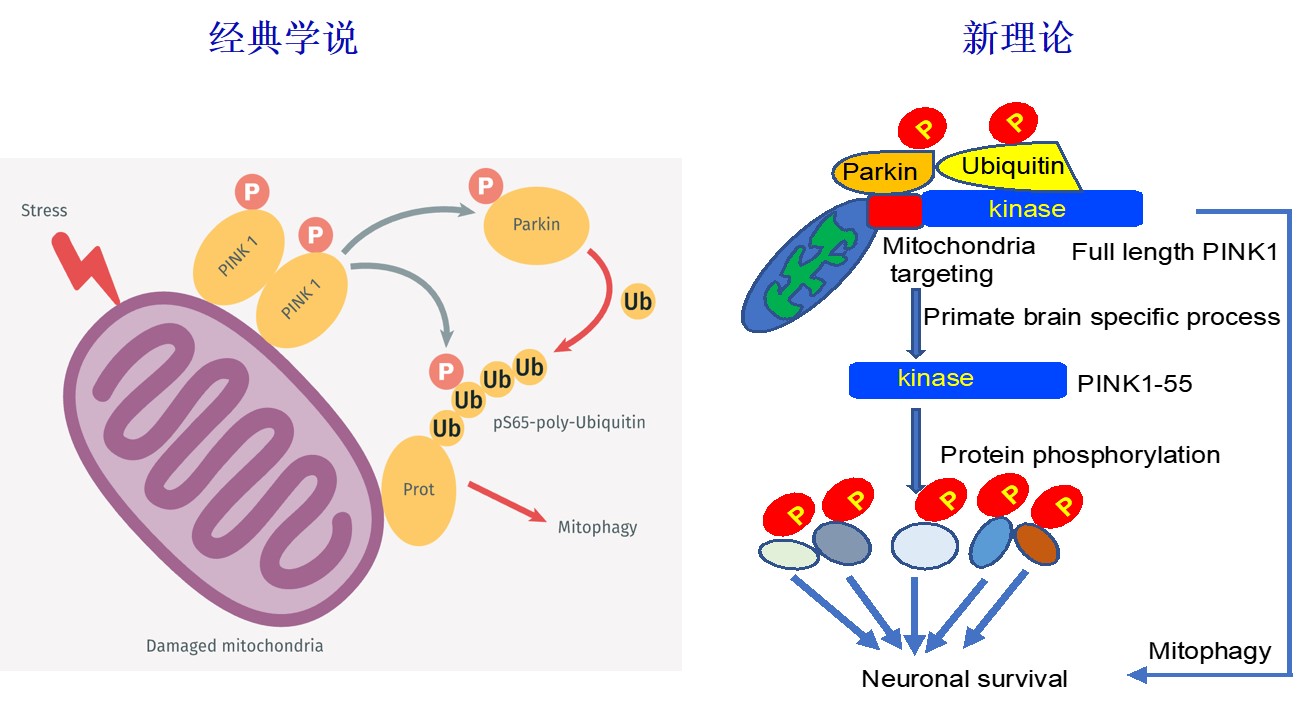
图2:PINK1参与线粒体自噬功能的经典学说主要依据于大量体外培养细胞实验的结果,而非人灵长类动物实验证明PINK1主要为激酶维持神经细胞生存(新理论)。因此,同一致病基因在体外与体内的功能可以是显著不一样并导致不同的病理变化。
该研究颠覆了长期以来建立在大量体外与小动物实验基础上的传统理论。美国科学院院士袁均瑛教授在同期杂志中撰文评论该研究挑战了PINK1维持线粒体功能的学说并提供了充分证据说明需要探究PINK1在帕金森病中的非线粒体功能 (https://link.springer.com/article/10.1007/s13238-021-00889-w)。国内外研究帕金森病的著名专家在BioArt的点评中也一致认为非人灵长类模型能更深入地揭示帕金森疾病的病理机制。结合近年来李晓江团队发现猪(Yan et al., Cell, 173(4):989-1002, 2018)及猴模型 (Yin et al., Acta Neuropathol, 137(6):919-937, 2019)能更好地模拟神经退行性疾病的典型病理变化,该研究进一步证实了有必要利用大动物模型来更准确揭示疾病机理及寻找到有效治疗方法。
论文的第一作者及共同通讯作者为暨南大学杨伟莉研究员。暨南大学郭祥玉副研究员,涂著池研究员及李世华教授等也参与了本项目的研究。华东师范大学的廖鲁剑教授团队为分析蛋白质磷酸化做出了重要贡献。李晓江教授为共同通讯作者。本项研究获得广东省科技厅项目基金,科技部国家重点研发计划及国家自然科学基金的资助。
论文链接:https://link.springer.com/article/10.1007/s13238-021-00888-x
(粤港澳中枢神经再生研究院 杨伟莉)
责编:苏倩怡




