
附属第一医院赵建夫/尹海燕/陈填烽团队在纳米药物逆转肺癌放疗抵抗取得新突破
近日,暨南大学附属第一医院赵建夫/尹海燕/陈填烽团队在构建新型纳米药物克服肺癌放射抗性的治疗上取得重要进展,相关研究成果“Reversing lung cancer radioresistance by hyperpermeable tellurium nanotherapeutics via remodeling tumor microenvironment”发表在国际著名期刊Nano Today (IF=18.962)。暨南大学附属第一医院为该研究的第一完成单位,赵凤芝主治医师为本论文的第一作者,黄炜博士后为本论文共同第一作者,赵建夫主任医师、尹海燕教授和陈填烽教授为共同通讯作者。

本单位大量临床病例研究发现:放疗耐受性是肺癌患者放疗失败的主要原因。因此,找到有效的靶点和信号通路来逆转放射抗性是治疗成功的关键所在。肿瘤放射抵抗治疗失败与表皮生长因子受体(EGFR)激活相关,EGFR下游多个信号通路的激活抵消了放疗的疗效,包括对肿瘤细胞增殖、DNA修复、缺氧和肿瘤转移的影响。另外,肿瘤细胞在放疗后可使EGFR激活,再次导致放射治疗耐受。同时,放疗疗效是基于电离辐射产生的高能量促进活性氧(ROS)的形成,从而诱导癌细胞死亡,细胞内大部分ROS是由线粒体产生。基于此,针对以EGFR和线粒体为靶点设计放射增敏剂是一种逆转放射耐受性、增强放疗疗效的潜在策略。
暨南大学附属第一医院赵建夫/尹海燕/陈填烽团队通过多学科交叉融合,一直致力于以临床问题为导向的化学创新药物设计与诊疗应用研究,在基于肿瘤生化特性的靶向药物设计、化疗增敏、放疗增敏及免疫调控研究方面做了多年的工作积累。基于硒族元素(碲,Te)纳米材料的优良的物理化学性质和增敏特性,该项研究以具有高放射增敏能力的碲纳米星(TeNSs)为核心,引导形成EGFR/线粒体双靶向碲基放射增敏剂(M-TeNSs@Ge-11)。
研究发现该纳米体系不仅在肺癌细胞中表现出增加的积累和穿透,而且增强了放疗耐受肺癌细胞对X射线的敏感性,从而通过刺激ROS产生和线粒体功能障碍实现了良好的体内外抗癌效果。此外,M-TeNSs@Ge-11联合X线治疗还可以调节肿瘤免疫微环境,通过调节M2表型的肿瘤相关巨噬细胞和增强NK细胞浸润,进一步增强抗肿瘤活性。
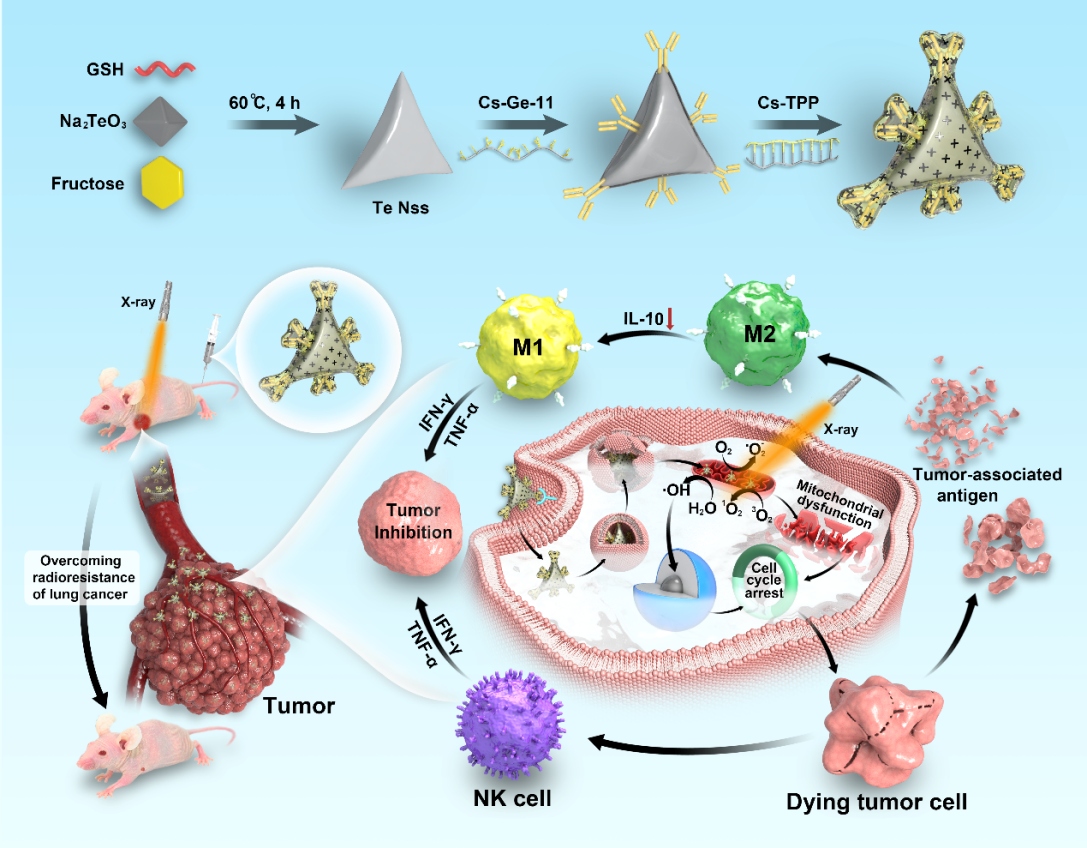
(该示意图概述了M-TeNSs@Ge-11的简单合成,揭示了通过重塑肿瘤微环境逆转肺癌辐射抵抗的机制)
上述研究工作得到了国家自然科学基金杰出青年基金、面上项目、广东省科技计划等项目的资助。
论文链接 https://www.sciencedirect.com/science/article/pii/S1748013223000683
(附属第一医院)
责编:李伟苗




