
药学院叶文才/张冬梅教授团队在肿瘤周细胞研究领域再获重要成果
暨南大学融媒体中心讯 近日,暨南大学药学院叶文才/张冬梅团队连续在本领域国际权威学术期刊《Gut》(IF=25.8)和《Nature Communications》(IF=15.7)上在线发表了题为“Pericyte drives the formation of circulating tumour cell-neutrophil clusters to promote colorectal cancer metastasis”和“Pericytes promote metastasis by regulating tumor local vascular tone and hemodynamics”的研究论文。
肿瘤远端转移是肿瘤致死的主要原因,但目前临床上仍缺乏有效治疗药物,亟需发现新靶标并研发原创新药。血行转移是肿瘤远端转移的主要途径,周细胞是覆盖在肿瘤血管外壁且具有收缩能力的基质细胞,被认为是肿瘤血管的“看门人”,其通过调控肿瘤血管稳态,决定了肿瘤细胞能否穿透血管壁渗入肿瘤血管这一血行转移的早期限速步骤。既往研究表明,肿瘤周细胞具有异质性,可抑制或促进肿瘤血行转移。因此,发现周细胞促肿瘤转移的分子机制和潜在新靶标,可发展周细胞靶向抗肿瘤候选新药,有助于实现肿瘤转移的早期防治,具有重要的临床意义和应用价值。
循环肿瘤细胞(circulation tumor cells,CTC)-中性粒细胞团簇的形成对肿瘤血行转移至关重要,但其形成的位置和机制未知。该团队利用多色免疫荧光,发现CTC-中性粒细胞团簇主要聚集于原发灶肿瘤血管内皮内壁;利用单细胞测序在肝转移性结直肠癌原发灶中发现了一种高表达烟酰胺N-甲基转移酶(NNMT)的周细胞新亚群;机制研究表明,肿瘤周细胞NNMT可通过分泌CXCL5激活CXCR2信号轴,促进血管-免疫界面上结直肠癌细胞、中性粒细胞和内皮细胞之间的相互作用,形成CTC-中性粒细胞簇,增强CTC的存活和转移能力,从而促进结直肠癌的肝转移。在以上研究基础上,该团队自行设计和研制了肿瘤周细胞NNMT靶向抑制剂Z-GP-NNMTi,可阻断 CTC-中性粒细胞簇的形成,从而有效抑制结直肠癌肝转移。(Gut. 2025 Aug 6:gutjnl-2024-334618)
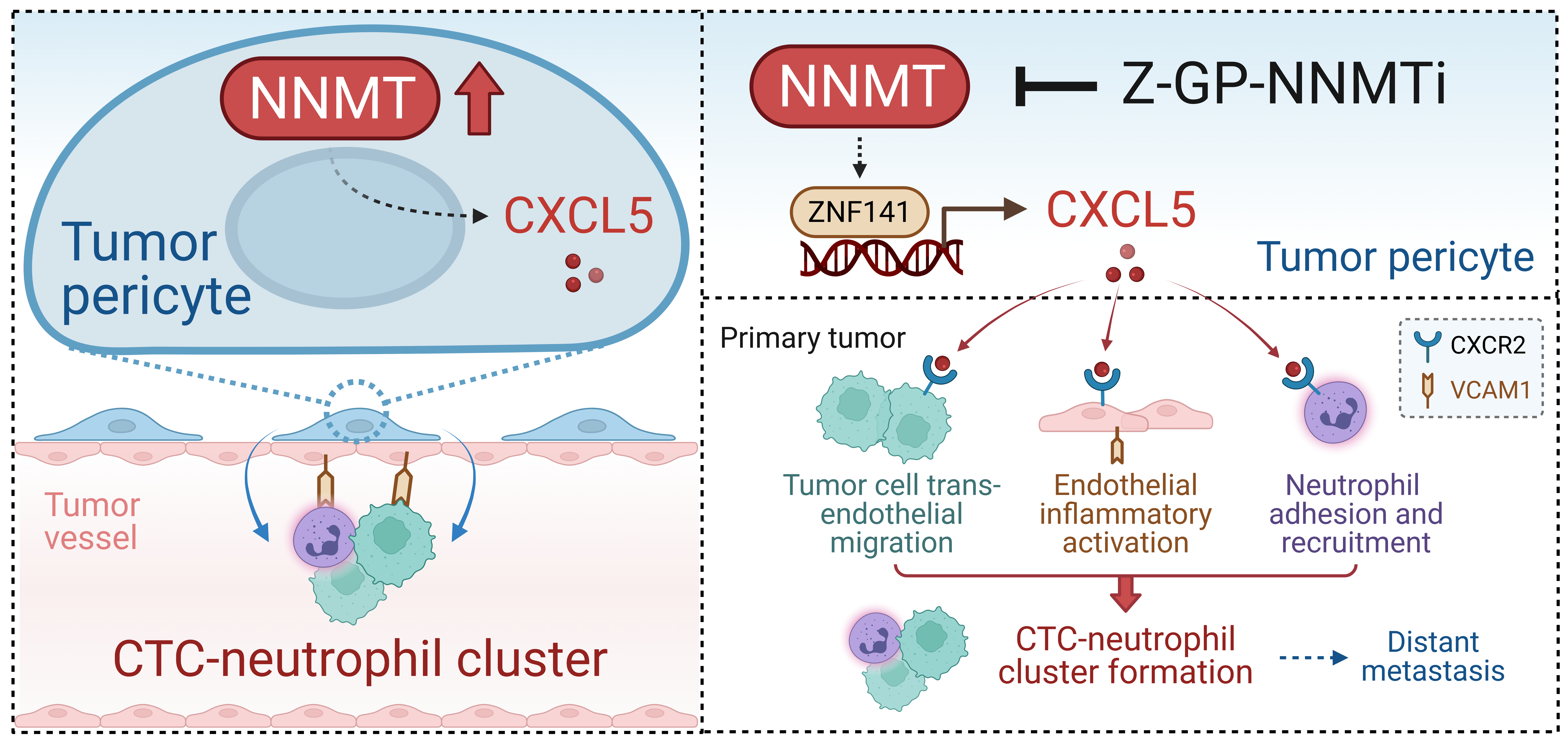
血液动力学对循环肿瘤细胞的存活和外渗具有重要作用,然而血液动力学对肿瘤细胞内渗的影响仍然未知。研究发现,原发灶中高表达NKX2-3的肿瘤周细胞可调控肿瘤血管舒张功能,促进结直肠癌肝转移。机制上,NKX2-3通过PDE1C/cAMP/PKA信号轴抑制肿瘤周细胞的钙内流,诱导肿瘤血管舒张,增加血通量和血管渗漏,促进结直肠癌患者的血行转移。通过基因缺失Nkx2-3或TCF21片段肽阻断肿瘤周细胞NKX2-3的转录活性,诱导肿瘤局部血管收缩,减少血流量,可显著抑制肿瘤转移。(Nat Commun. 2025 Aug 2;16(1):7115)
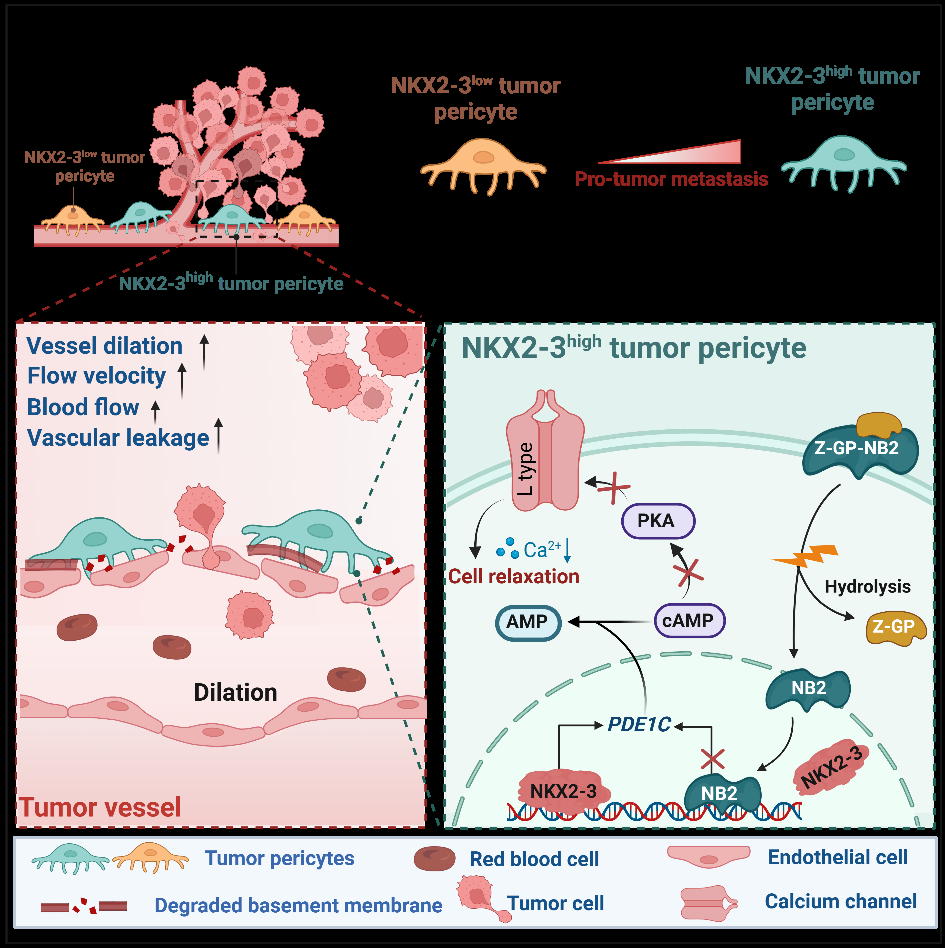
该团队深入揭示了肿瘤周细胞的异质性特征及其生物学功能,系统阐明了周细胞在肿瘤转移进程中的关键调控机制,成功发现了多个周细胞特异性潜在新靶标,并发展了周细胞靶向肿瘤抑制剂。以上研究成果不仅深化了对肿瘤转移的生物学过程和调控机制的认识,也为肿瘤临床治疗策略的发展开辟了新的道路,具有重要的学术价值和广阔的转化应用前景。
全文链接:
https://gut.bmj.com/lookup/pmidlookup?view=long&pmid=40701795
https://www.nature.com/articles/s41467-025-62475-6
责编:李梅




