
基础医学与公共卫生学院李平团队在卵巢子宫内膜异位恶变机制研究取得突破 相关成果发表于Cell Reports Medicine
暨南大学融媒体中心讯 卵巢癌被称为女性健康的“沉默杀手”,而子宫内膜异位相关性卵巢癌(EAOC)作为其重要亚型,不仅发生率逐年上升,还呈现发病年龄提前、早期诊断困难的特点,严重威胁女性生命健康。长期以来,EAOC的发生机制不明,相关研究因缺乏理想模型而进展滞后。
近日,基础医学与公共学院李平研究团队在Cell Reports Medicine发表了题为:Therapeutic targeting of interleukin-17C signaling in carcinogenesis of endometriosis的研究,创新性提出“腹腔液IL-17C因子驱动EM恶变”的关键机制。这一发现打破了以往对EM恶变的认知局限,不再局限于共同基因突变的泛化研究,而是聚焦腹腔液免疫微环境的调控作用,明确IL-17C 是驱动EM从良性病灶向恶性转化的关键因子。
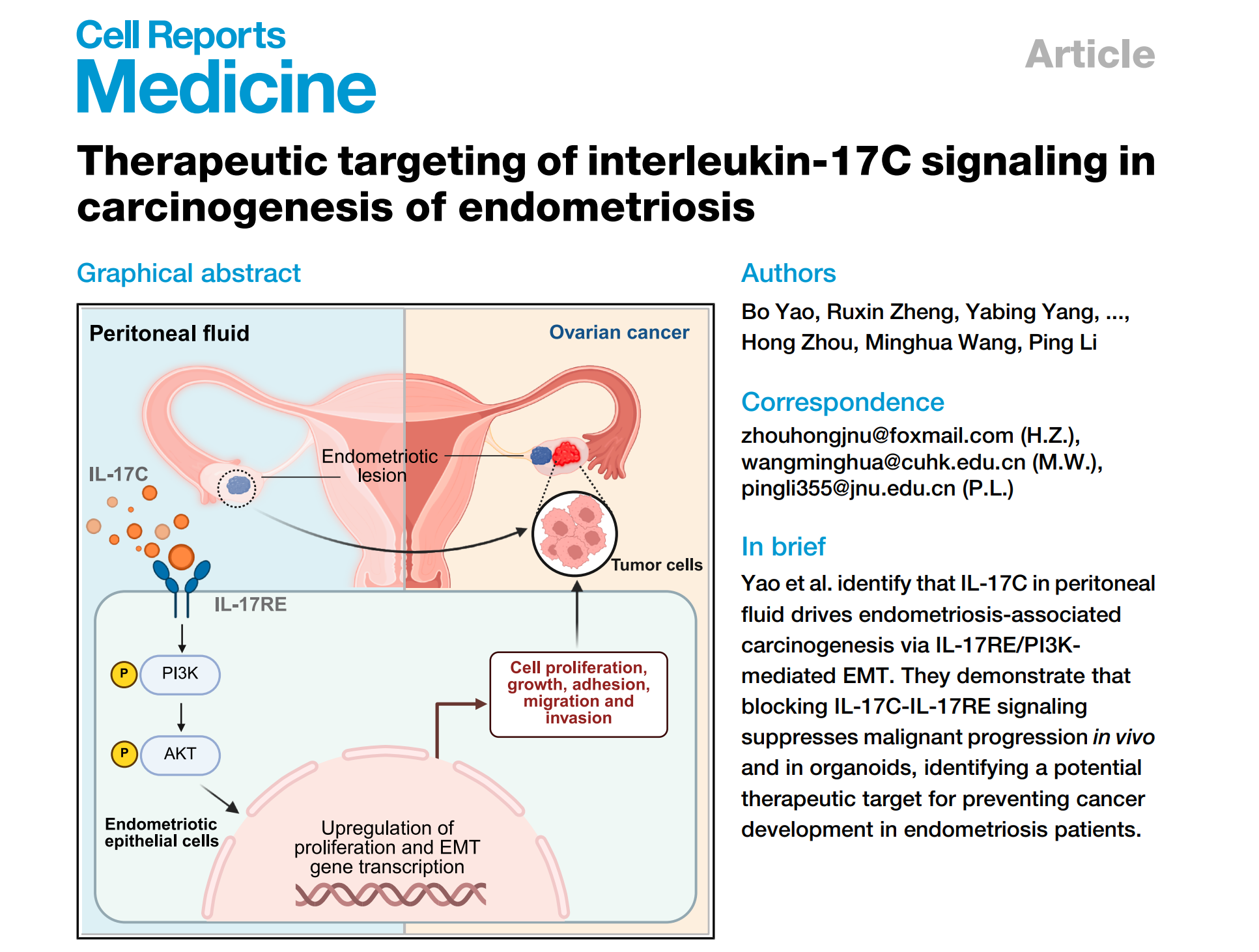
该研究通过空间转录组技术发现,IL-17C/IL-17RE信号通路在EAOC的癌上皮细胞中被特异性激活。研究证实,EAOC患者腹腔液中IL-17C水平异常升高,且与肿瘤大小、临床分期及不良预后密切相关。外源IL-17C能直接作用于子宫内膜异位症(EM)异位上皮细胞,促进其增殖、迁移及恶性转化,同时引发类器官结构改变。这一机制明确了EM 恶变的关键路径:腹腔液中异常升高的IL-17C结合异位内膜表面的IL-17RE受体,激活下游PI3K通路,最终增强细胞恶性转化与腹腔种植能力,逐步发展为EAOC。
基于上述机制,研究进一步验证了靶向治疗的可行性:在卵巢异位症和腹腔异位症小鼠模型中,通过基因敲除IL-17C,或腹腔注射IL-17C中和抗体MOR106,能有效阻遏IL-17C诱导的异位病灶进展和播散;而过表达腺相关病毒IL-17RE定点注射异位病灶,则会显著促进病灶生长及腹腔种植。这一结果表明,靶向中和或阻断腹腔液IL-17C/IL-17RE信号轴,可成为抑制EM恶变及腹腔转移的有效策略,为EAOC的靶向治疗提供了全新的潜在靶点。
该项研究,从调控细胞恶变的角度,揭示了腹腔液来源IL-17C在EAOC发生中的核心作用,不仅填补了EM良性向恶性转化分子机制研究的空白,更创新性地提出干预腹腔液免疫环境的治疗思路,为EAOC的早期预警、风险评估提供了新的生物标志物,也为开发针对性的靶向药物奠定了坚实的理论基础。国际权威期刊审稿人评价,该研究对子宫内膜异位症恶变机制研究具有重要贡献。
暨南大学硕士研究生姚博、郑如心,博士后杨亚兵为论文的共同第一作者,基础医学与公共卫生学院病理学系副教授李平为论文的主通讯作者,香港中文大学(深圳)附属第二医院病理科主任王明华、暨南大学附属第一医院生殖医学中心周宏为论文的共同通讯作者。
论文链接:
https://linkinghub.elsevier.com/retrieve/pii/S2666379125005373
责编:陈国琼




