
我院罗钧洪教授与奥斯陆大学Evandro Fei Fang团队在Science Advances发表合作研究论文
暨南大学融媒体中心讯 近日,我院罗钧洪教授团队与奥斯陆大学Evandro Fei Fang(方飞)教授团队、米尼奥大学Joana Margarida Silva教授团队合作,在Science Advances发表了题为“NAD⁺reverses Alzheimer's neurological deficits via regulating differential alternative RNA splicing of EVA1C”的研究成果。

该研究首次揭示了NAD⁺通过调控关键蛋白EVA1C的可变剪接,逆转阿尔茨海默病相关神经功能障碍的新机制,为基于“剪接开关”的阿尔茨海默病干预策略提供了理论基础和潜在靶点。
阿尔茨海默病(Alzheimer's disease, AD)是最常见的神经退行性疾病,随着人口老龄化加剧,其发病率持续上升,但目前尚无根治手段。NAD⁺作为维持神经元能量代谢和抗衰老的重要分子,在多种动物模型中被证实可延缓认知退化,但其作用于RNA可变剪接及神经保护的分子机制尚不清楚。
团队通过整合多物种转录组学分析、深度学习结构预测与跨物种实验验证,系统揭示了NAD⁺在Tau蛋白病理条件下对RNA剪接调控的全景效应。在人源Tau突变小鼠(hTau.P301S)中,509个基因存在显著剪接异常,其中与线粒体功能和突触活动相关的外显子跳跃事件尤为突出。补充NAD⁺前体后,剪接体相关基因表达得到显著恢复,RNA剪接稳态重新建立。
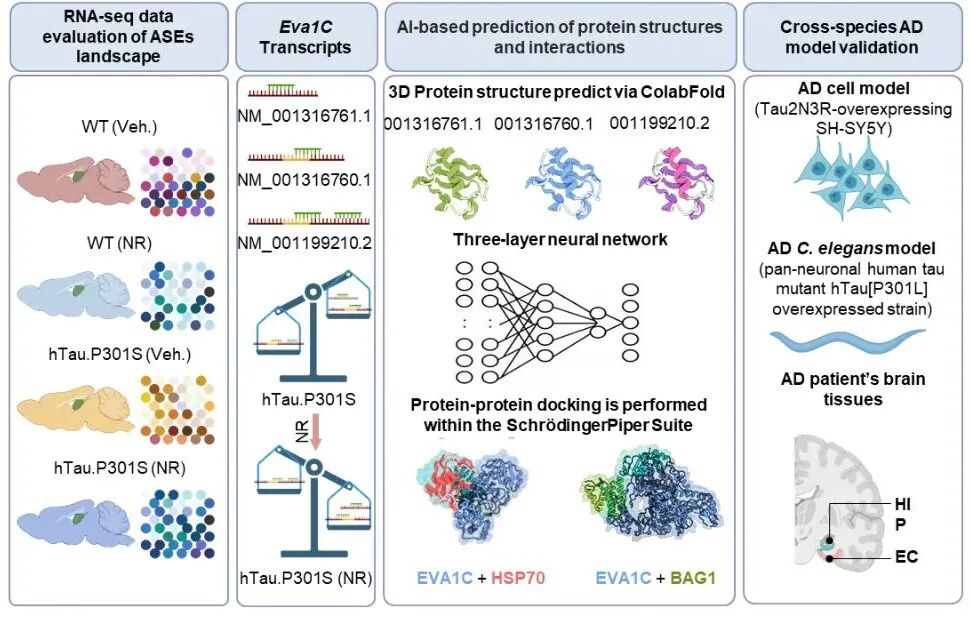
研究进一步分析发现,EVA1C基因的可变剪接是NAD⁺作用的关键环节。EVA1C编码一种免疫球蛋白超家族膜蛋白,在神经发育和轴突导向中起重要作用,NAD⁺可通过调控EVA1C剪接异构体的表达比例,恢复神经元的突触传导与线粒体稳态,从而改善记忆和认知功能。
在跨物种验证实验中,团队发现NAD⁺补充可显著延长阿尔茨海默病模型线虫寿命16.8%,并改善学习记忆能力;而在eva-1(EVA1C同源基因)敲低后,这些效应完全消失。在小鼠模型中,通过腺相关病毒介导的EVA1C敲低同样能抵消NAD⁺带来的记忆改善,进一步证实了“NAD⁺–EVA1C剪接轴”在神经保护中的核心作用。
该研究提出了代谢物通过RNA可变剪接实现神经稳态重建的新概念,为阐释NAD⁺在衰老与神经退行性疾病中的多层调控机制提供了重要线索。首次将NAD⁺与RNA剪接机制联系起来的阿尔茨海默病研究,为当前利用NAD⁺增强策略治疗阿尔茨海默病的临床研究提供了坚实的机制基础。
奥斯陆大学博士艾瑞雪(Ruixue Ai, Alice),暨南大学附属第一医院博士后茅立鹏、晋旭睿,葡萄牙米尼奥大学博士Carlos Campos-Marques等为本论文共同第一作者;奥斯陆大学教授Evandro Fei Fang(方飞)、暨南大学基础医学与公共卫生学院教授罗钧洪、米尼奥大学教授Joana Margarida Silva为共同通讯作者。该研究得到了国家自然科学基金等项目的支持。
论文链接:https://www.science.org/doi/epdf/10.1126/sciadv.ady9811
责编:陈国琼




